
專屬客服號

微信訂閱號
全面提升數據價值
賦能業務提質增效
近年來血液系統常見惡性腫瘤如白血病、骨髓瘤、淋巴瘤等雖經化療及骨髓移植技術的應用取得了巨大進步,但仍有較高的治療失敗率,耐藥及復發的問題仍然難以克服。因此另辟蹊徑、探尋更加安全有效的治療手段是當務之急。
2013年嵌合抗原受體T細胞(CAR-T)治療被《科學》(Science)雜志評選為“十大科技進展”之首。2014年的美國血液學會(ASH)年會上,CAR-T細胞治療在急性淋巴細胞白血病(ALL)中取得了顯著療效的報道亦大放異彩,給血液惡性腫瘤的治療帶來希望之光。
(一)CAR-T的5年:從實驗室到臨床
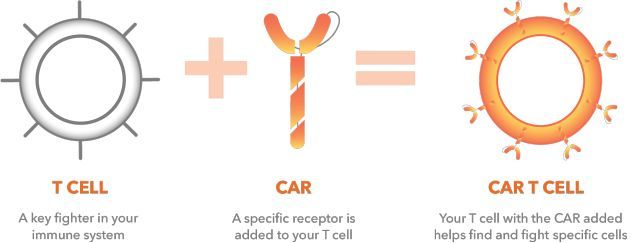
CAR-T細胞免疫療法的現狀及思考
▲ 一圖解說CAR-T含義:免疫系統中的T細胞與一種特定受體“組合”在一起就是CAR-T(圖片來自網絡)
CAR-T細胞治療是應用患者自身的白細胞(T淋巴細胞),經過實驗室的重新改造,裝載上具有識別腫瘤抗原的受體及共刺激分子,體外擴增后再次回輸入患者體內,從而識別并攻擊自身的腫瘤細胞。
2017年8月30日美國FDA批準了第一個用于癌癥的基因治療方法,即tisagenlecleucel(Kymriah)應用于兒童及年輕成人復發及耐藥的ALL患者的治療。
Axicabtagene ciloleucel是2017年美國FDA第二個批準的細胞療法,用于成人特定種類的非霍奇金淋巴瘤,包括彌漫大B細胞淋巴瘤,原發縱隔的B細胞淋巴瘤,轉化的濾泡淋巴瘤。
隨著抗CD19的CAR-T細胞治療在ALL中取得的成功[1, 2],在包括多發性骨髓瘤[3, 4]、淋巴瘤[5, 6]及急性髓系白血病[7]等其他類型的白血病中也開展了廣泛的嘗試。CAR-T細胞的嵌合抗原受體(CAR)設計由細胞外抗原結合區、跨膜區和胞內信號轉導區組成。其嵌合抗原受體針對腫瘤相關抗原,因此具有高度特異性,且不受主要組織相容性復合物(MHC)的限制,因此腫瘤抗原亦不受種類的限制,除可選擇蛋白多肽外,還包括神經節苷脂、有機糖類抗原等。
(二)CAR-T與急性髓系白血病:ELIANA試驗
國際上針對ALL最受關注的臨床試驗之一是tisagenlecleucel(諾華CTL019)。Maude等在《新英格蘭醫學雜志》(N Eng J Med)[2]上發表了tisagenlecleucel的ELIANA臨床試驗更新結果。
75例復發或耐藥的兒童及年輕成人ALL患者接受了tisagenlecleucel治療,中位隨訪時間13.1個月,60例患者達完全緩解(CR/CRi),6個月的無復發生存率(RFS)為80%,6個月及12個月的無事件生存率(EFS)分別為73%及50%,總生存率(OS)分別為90%及76%。Tisagenlecleucel在體內可被檢測達20個月,中位存續時間為168天。
95%的患者出現治療相關的副反應(所有級別),最常見的非血液學毒副反應事件為細胞因子釋放綜合征(CRS,77%),發熱(40%),食欲減退(39%),中性粒細胞減少伴發熱(36%)及頭痛(36%)。CRS是已知的tisagenlecleucel細胞在體內活化產生的并發癥,根據CRS分級系統,46%的患者發生了3~4級的CRS(3級21%,4級25%),35例患者(47%)進入ICU,40%患者在注射細胞的8周內出現了神經系統事件,其中3級的患者共10例(13%),經支持治療后好轉,4級神經毒性事件及腦水腫未見。
(三)CAR-T與耐藥大B細胞淋巴瘤
01 里程碑試驗 ZUMA-1
作為第一個在傳統治療失敗的耐藥大B細胞淋巴瘤的CAR-T細胞治療多中心、Ⅱ期臨床試驗,靶向CD19的CAR-T細胞(axicabtagene ciloleucel)治療復發及耐藥的侵襲性B細胞淋巴瘤的ZUMA-1臨床試驗是該領域的里程碑,由來自MD安德森癌癥中心(MD Anderson Cancer Center)的Neelapu及同事在N Eng J Med雜志[6]上發表并在ASH及美國臨床腫瘤學會(ASCO)上報告。
該研究共納入111例患者(彌漫大B細胞淋巴瘤,原發縱隔B細胞淋巴瘤,轉化的濾泡細胞淋巴瘤),共101例患者成功制備并接受治療,中位年齡58歲(23~76歲),85%的患者分期在Ⅲ或Ⅳ期,77%對二線或以上的治療耐藥,21%為移植后復發,69%的患者至少接受3個前期治療,26%的患者原發耐藥。
截止2017年8月,中位隨訪時間15.4個月,42%的患者持續反應,完全反應達40%。反應的中位持續時間達11.1個月,中位PFS為5.8個月,6個月、12個月及15個月的PFS分別為49%、44%及41%,OS分別為78%,59%及52%。
發生任何級別的常見副反應患者達85%,副反應≥3級的達95%,最常見的為中性粒細胞減少(78%)、貧血(43%)、血小板減少(38%)、發熱伴中性粒細胞減少(31%)及腦病(21%)。94例患者出現CRS(93%,1-2級占81%,3-4級占13%),≥3級的神經系統事件為28%,治療期間死亡患者3例。
整體來說CAR-T細胞治療取得了高水平的持續反應,毒副反應方面包括骨髓抑制,CRS及神經系統事件均表現安全。
02 CTL019:另一種選擇
另一項發表在NEJM雜志的研究提供了其他的抗CD19的CAR-T細胞治療選擇(CTL019)[5],共納入28例復發/耐藥的彌漫大B細胞淋巴瘤(14例)及濾泡淋巴瘤(14例)患者,中位隨訪時間28.6個月,64%的患者(18/28)獲得反應,在彌漫大B細胞淋巴瘤及濾泡淋巴瘤患者中的完全緩解率分別為43%(6/14)及71%(10/14),且所有在6個月達到完全緩解的患者在7.7~37.9個月(中位數:29.3個月)時仍可維持緩解狀態。
發生嚴重的CRS反應有5例(18%),≥3級的腦病3例(11%),其中2例呈自限性過程,1例死亡。
(四)CAR-T與多發性骨髓瘤:中國的LEGEND-2試驗
從2016年開始,西安交通大學第二附屬醫院血液科開展了一項單臂、開放標簽的在難治/復發的多發性骨髓瘤患者應用針對B細胞成熟抗原(BCMA)雙表位的LCAR-B38M CAR-T細胞治療臨床試驗(NCT03090659)。
截止2018年1月總結了45例患者的臨床資料,中位隨訪9.30(1.73~21.40)個月,總反應率達95.56%(43/45),30例獲得完全反應(CR為66.67%),10例獲得了很好的部分反應(VGPR為22.22%),且治療反應隨著時間的推移而改善。1年OS率為86.36%,EFS為54.89%,PFS率為58.91%。
未觀察到與劑量有關的不良事件。CRS發生率為93.33%,3例 (6.67%)發生了3級CRS,未見4級及以上CRS(資料待發表)。與目前國際上已有報道的在難治/復發多發性骨髓瘤的CAR-T細胞療法相比,效果顯著且副反應安全可控。
(五)CAR-T細胞免疫療法的6大挑戰
隨著CAR-T細胞治療在血液病中獲得的巨大成功,在實體腫瘤乃至許多慢性疾病中,其可能亦蘊藏著廣闊的應用前景。但仍需更多基礎與臨床前研究和臨床試驗的經驗積累,同時也面臨著許多挑戰。
目前,科學家及臨床醫生們還在CAR-T細胞的設計、預處理方案的選擇和優化、CAR-T細胞的輸注劑量、細胞炎癥因子釋放等合并癥的管理上不斷探索。
挑戰1:找到有效且腫瘤特異性的靶抗原
該抗原在腫瘤細胞表達高而在正常組織及造血干細胞表達低甚至不表達為佳,因此需要進行大量的前期探索工作。
挑戰2:進一步延長患者獲益時間
部分達到最佳療效的患者仍會出現疾病的進展及復發,仍可能面臨腫瘤逃逸及腫瘤表面抗原丟失導致的治療無效的問題(雖然axicabtagene ciloleucel在ZUMA-1臨床試驗中取了顯著的反應率,但仍有超過一半的患者無法達到持久的反應)。包括在治療選擇中,是先移植再行CAR-T細胞治療鞏固,或先經CAR-T細胞治療減低腫瘤負荷后橋接移植,CAR-T細胞治療與傳統及新的靶向分子藥物如何結合才能最大程度使患者獲益?
挑戰3:明確毒性機理
細胞因子釋放、神經毒性發生的機理及控制仍不夠明確,探索提示其發生并能阻斷其毒性反應的敏感的生物標志。
挑戰4:開發更安全高效的CAR-T細胞構建技術
CAR-T細胞制備需要采集患者外周T細胞并運送至GMP實驗室,制備成本昂貴,過程復雜且有細胞擴增不良等制備失敗的可能。
因此利用基因編輯技術構建出既能針對腫瘤抗原又不產生移植物抗宿主病(GVHD)的通用型CAR-T細胞將是未來的努力方向。
挑戰5:完善監管機制
監管方面,近年來國家對細胞治療作為第三類技術要求備案,給了我國CAR-T療法飛速發展及成熟以時機,目前對CAR-T細胞治療汲取國外經驗作為藥品進行監管,需完善并進行臨床試驗審批的流程。
挑戰6:控制成本,合理定價
患者最關注也最實際的價格問題,美國的標價在)73,000(axicabtagene ciloleucel)~<75,000(tisagenlecleucel)美金之間,費用昂貴,據我國國情絕大多數患者無力支付,如何降低成本、實現通用及量產才能使其真正作為藥品,更多的造福于廣大患者。
(六)五問CAR-T:任重而道遠
1.所有的CAR-T細胞治療的臨床實驗中,雖然取得了矚目的效果,但仍有部分患者無法從CAR-T療法中獲益,這其中出現不同反應的原因是什么?
2.我們也觀察到,有部分CAR-T細胞治療后再次出現疾病進展/復發的患者,仍然存在BCMA的表達,這其中的原因可能是什么?
3.何時選擇CAR-T細胞治療能夠使患者最大獲益?
4.CAR-T細胞治療經過更多的臨床驗證其安全有效后,相較化療患者普遍表示生活質量較高,是否可能將其作為一線的治療?
5.CAR-T治療前、治療中哪些指標,觀察到可能與患者的預期療效相關?或者CRS等毒副反應相關?
參考文獻
1. Grupp, S.A., et al., Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. N Engl J Med, 2013. 368(16): p. 1509-1518.
2. Maude, S.L., et al., Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med, 2018. 378(5): p. 439-448.
3. Garfall, A.L., et al., Chimeric Antigen Receptor T Cells against CD19 for Multiple Myeloma. N Engl J Med, 2015. 373(11): p. 1040-7.
4. Ali, S.A., et al., T cells expressing an anti-B-cell maturation antigen chimeric antigen receptor cause remissions of multiple myeloma. Blood, 2016. 128(13): p. 1688-700.
5. Schuster, S.J., et al., Chimeric Antigen Receptor T Cells in Refractory B-Cell Lymphomas. N Engl J Med, 2017. 377(26): p. 2545-2554.
6. Neelapu, S.S., et al., Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med, 2017. 377(26): p. 2531-2544.
7. Chen, L., et al., Targeting FLT3 by chimeric antigen receptor T cells for the treatment of acute myeloid leukemia. Leukemia, 2017. 31(8): p. 1830-1834.
作者 | 趙萬紅(西安交通大學第二附屬醫院)
編輯 | 賈春實 丁雨竹(中國醫學論壇報)
本文為本網轉載,出于傳遞更多信息之目的,并不意味著贊同其觀點或證實其內容的真實性,如涉及侵權,請權利人與本站聯系,本站經核實后予以修改或刪除。


請完善以下信息,我們的顧問會在1個工作日內與您聯系,為您安排產品定制服務
評論