
專屬客服號

微信訂閱號
全面提升數(shù)據(jù)價值
賦能業(yè)務提質增效
摘要:隨著我國政府對醫(yī)藥行業(yè)的大力扶持,我國生物類似藥的發(fā)展也呈現(xiàn)上升的趨勢,但是由于起步較晚,相比于歐美日等發(fā)達國家,我國在生物類似藥的研發(fā)上仍存有較大差距,但是在政策、數(shù)據(jù)、資本及消費的刺激下,我國生物類似藥的發(fā)展將迎來新的機遇,有望實現(xiàn)彎道超車。
近年來,全球范圍內醫(yī)療產業(yè)的發(fā)展重心逐漸轉向生物醫(yī)藥方向,其市場的比重不斷增大。在我國,生物醫(yī)藥處于剛剛起步階段,整體的研發(fā)水平、技術人才等與歐美存有差距,但我國人口眾多,且處于消費升級的時間段,生物類似藥在我國有著龐大的發(fā)展空間,國內生物類似藥的上市數(shù)量和速度將快速增長,甚至有望實現(xiàn)彎道超車。
生物類似藥的審批流程尚未形成,研發(fā)數(shù)量已居世界首位
我國生物類似藥的注冊管理仍處于空白狀態(tài),相應的配套政策尚未形成,遠遠滯后于產業(yè)的發(fā)展現(xiàn)狀。2015年我國食藥監(jiān)審評中心發(fā)布的《生物類似藥研發(fā)與評價技術指導原則(試行)》是生物類似藥的第一個指南性文件,為我國生物類似藥的研發(fā)、上市的評價提供了基本原則。2016年發(fā)布的《藥品注冊管理辦法(修訂稿)》文件中進一步規(guī)范了生物類似藥的具體概念和審批標準,由于政策的出臺現(xiàn)階段我國藥企已經在嘗試無需經過II期臨床的生物類似藥的審批流程,如復宏漢霖已經申報上市的利妥昔單抗類似藥。相關法律法規(guī)的缺失使得我國生物類似藥的上市面臨眾多挑戰(zhàn),如說明書問題、命名問題等是目前生物類似藥領域亟需解決的問題。
據(jù)IMS統(tǒng)計,截止到2018年5月,我國約有270個生物類似藥處于研發(fā)狀態(tài),是全球生物類似藥研發(fā)數(shù)量最多的國家,其中約有一半處于臨床前研究階段,65個已提交IND申請,10個已經獲得臨床批件,有望近期開展臨床試驗。
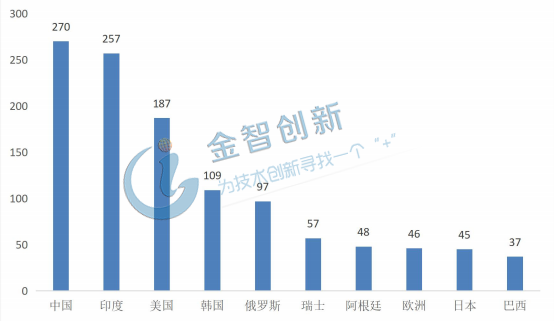
圖1 各國家和地區(qū)生物類似藥在研數(shù)目
(資料來源:湯森路透,五度易鏈行研整理)
數(shù)據(jù)、資本、消費為中國生物醫(yī)藥發(fā)展帶來機遇
全球生物醫(yī)藥的重要性日漸提升,面對歐美等發(fā)達國家的發(fā)展先例,我國生物醫(yī)藥領域的發(fā)展也迎來新的機遇。
數(shù)據(jù)優(yōu)勢:我國擁有龐大的人群樣本數(shù)據(jù),生物制藥方面,對于研發(fā)和用藥階段的數(shù)據(jù)量要求較高,我國在數(shù)據(jù)方面擁有天然的優(yōu)勢,收集數(shù)據(jù)的時間要比美國縮短10倍,且不存在數(shù)據(jù)不同源的問題,極大的降低生物藥研發(fā)花費的時間成本。龐大的人口帶來大樣本數(shù)據(jù),為我國新藥生物藥的研發(fā)帶來極大的優(yōu)勢。
資本綠燈:眾所周知資本是打開市場的綠燈,資本市場是支持新經濟形態(tài)、經濟轉型及實現(xiàn)資源配置的源頭和介質。生物醫(yī)藥的研發(fā)是個風險交到的投入,需要多年無回報的投入,而我國香港資本市場為這些企業(yè)打開綠燈,港交所規(guī)定允許未有盈利的生物技術企業(yè)在港上市,這為我國乃至全球的生物醫(yī)藥公司獲取資本支持提供了極大的便利。
消費升級:目前我國處于消費升級的新階段,WTO后的出口長時間的拉動國內GDP增長,固定資產將不動產的價格不斷推高,隨著我國各地區(qū)GDP迅速的提高,對生活質量有更高追求的中產新生代成為消費的主力軍,隨著生物制藥的高歌猛進,人們對治好重癥病充滿了信心,可以預計愿意為新型特效藥消費的人群將會越來越多。
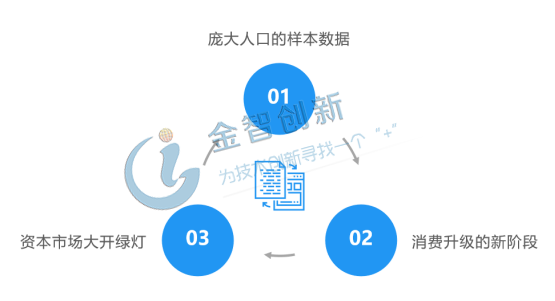
圖2 中國生物醫(yī)藥市場發(fā)展機遇
(資料來源:五度易鏈行業(yè)研究中心)
隨著我國首個生物類似藥的獲批,各企業(yè)加大對類似藥的布局
2019年2月,國家藥監(jiān)局發(fā)布通知,批準復宏漢霖研發(fā)的利妥昔單抗注射液的上市申請,利妥昔單抗注射液成為我國首個獲批的生物類似藥。隨著復宏漢霖利妥昔單抗的上市,國內生物類似藥的研發(fā)熱情進一步高漲,國內生物類似藥研發(fā)品種主要集中在利妥昔單抗、阿達木單抗、曲妥珠單抗3個單克隆抗體/融合蛋白的藥物。
利妥昔單抗:復宏漢霖針對 DLBCL 適應癥申報生產,為國內首家;神州細胞和信達生物均為臨床三期,進展比較靠前。同時,復宏漢霖針對 RA 適應癥在臨床 I期,為國內首家。
曲妥珠單抗:嘉和生物的抗 HER2 單抗于 2016 年 3 月開展臨床 III 期,為目前進展最快的產品;復宏漢霖曲妥珠單抗生物類似藥于 2016 年 9 月進入臨床 III 期,排名第二。百奧泰針對乳腺癌適應癥于 2018 年 3 月進入臨床 III期。其他企業(yè)處于臨床 I期或者臨床前研究階段。
阿達木單抗:競爭最為激烈,目前信達生物、百奧泰、海正藥業(yè)針對強制性脊柱炎進入臨床 III 期,排隊靠前;蘇州眾合、嘉和生物和上海賽金針對類風濕性關節(jié)炎適應癥進入臨床 III 期;復宏漢霖針對銀屑病適應癥進入臨床 III期,為該適應癥國內最快。另有多家企業(yè)在研。
表1 我國企業(yè)在重磅生物類似藥的布局

(資料來源:五度易鏈行業(yè)研究中心整理)
結語
綜上所述,雖然我國在生物類似藥領域的審批流程及相應配套政策尚未形成,但研發(fā)數(shù)量已居世界第一,我國任何行業(yè)的發(fā)展都是在量的基礎上打開質的突破,同時我國天然的大數(shù)據(jù)優(yōu)勢、資本綠燈和消費升級為我國生物藥的發(fā)展帶來新的機遇。隨著我國復宏漢霖利妥昔單抗注射液的批準上市,國內生物類似藥的研發(fā)熱情進一步高漲,各大藥企加快對生物類似藥的研發(fā)布局,些許企業(yè)有望實現(xiàn)彎道超車。
本文為我公司原創(chuàng),歡迎轉載,轉載請標明出處,違者必究!
請完善以下信息,我們的顧問會在1個工作日內與您聯(lián)系,為您安排產品定制服務
評論