
專屬客服號

微信訂閱號
全面提升數據價值
賦能業務提質增效
2019年,國內創新藥領域的投融資總額下滑了。在整體投融資環境趨冷的情況下,即使是創新藥這個醫療健康行業中最熱門的領域也難以幸免。
2018年國產創新藥迎來井噴態勢,到2019年這股熱潮仍在繼續。但在投融資方面,隨著資金投入的收緊,2019年的投資人們開始更加理性的觀測創新藥領域,從中擠出2018年鼓吹出的泡沫。
動脈網通過回顧數據和分析環境,對2019年的創新藥領域做出五點總結:
1.投融資較2018年有部分回落,但仍保持在2015-2017的穩定增長曲線上;
2.多個里程碑式產品獲批,國產創新藥出海獲得零的突破,國產創新藥開始進入國際市場;
3.大分子生物類似藥開始產出,重點品種實現國產化;
4.醫保的“騰籠換鳥”成功實施,新特藥大面積納入醫保;
5.科創板開放,港股熱門,創新藥企業開始大批量上市。
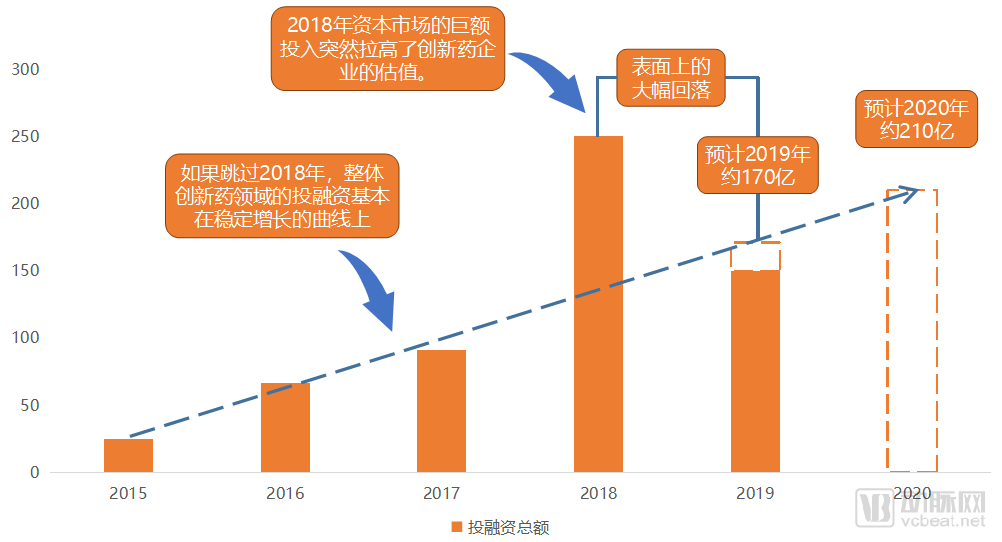 創新藥領域投融資總額情況
創新藥領域投融資總額情況
今年大家都在說創新藥投資遇冷。的確,根據動脈網知識庫統計的數據,與2018年相比,創新藥投融資到11月15日為止只收獲了不到150億元的融資總額。預計全年投融資將從2018年的250億降低32%至170億。
但如果我們拋開2018年不看,2015-2017加上2019年,創新藥投融資其實整體處在一條比較平穩的上升曲線上。因此,與其說2019年創新藥投資遇冷,不如說2018年創新藥投資過于火爆,導致2019年無法繼續保持2018年同期水平。
我們預計2019年全年投融資將達到170億人民幣。隨后的2020年國內創新藥領域的投融資仍會較2019年增長,預計2020年全年投融資將在200-210億人民幣。
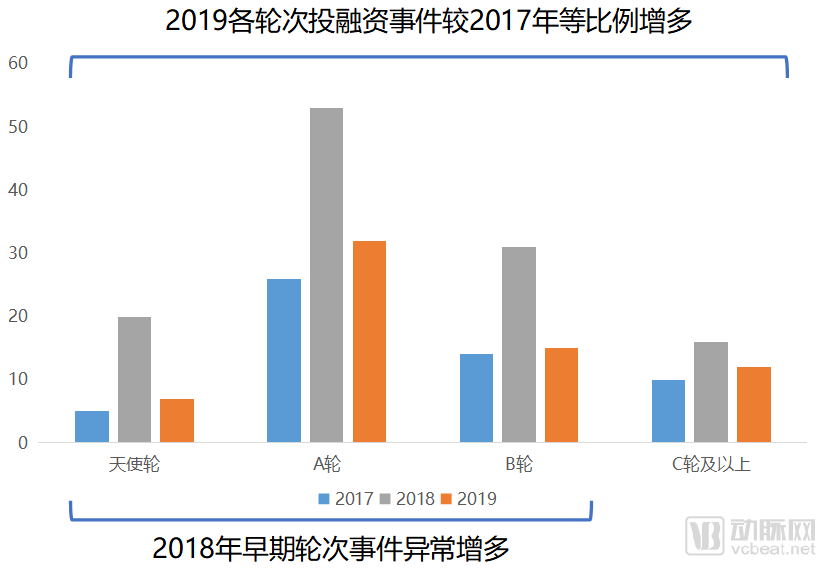
創新藥領域投融資輪次分布
從投融資結構的角度,我們也可以看出整體2019年的投融資輪次分布與2017年更加接近,2018年則發生了大幅的輪次前移。在2019年投資環境趨于冷靜的情況下,投融資輪次回歸正常的分布情況。這也代表了創新藥領域已經成為一個穩定運轉的細分領域。
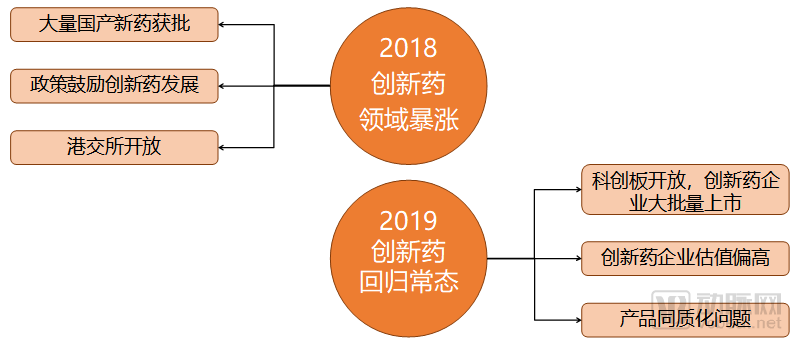
近兩年影響創新藥領域投融資變化的主要因素
對于大多數行業來說,2019年的資本寒冬可能是一場雪災,但對于創新藥行業則更像是一劑良藥。在多個不利因素的調節下,創新藥領域在2019年終結了2018年的不理智再度揚帆起航。
2019年,創投領域的資金短缺讓投資人們能重新冷靜的審視創新藥領域的投融資選擇,而不是像2018年一樣大筆揮毫。在2018年的拉動下,創新藥領域確實產生了大量泡沫,但是我們接觸的投資人很多都表示,雖然有泡沫,但是在2019年的環境里已經擠得差不多了。所以投資人們一邊抱怨著創新藥企業估值高,另一邊都還是心甘情愿的往創新藥投入。
產品同質化可能是目前創新藥領域面臨的最大問題,最典型的就是PD-1單抗。目前申報NDA的四種國產PD-1單抗已經全部獲批。但是據我們此前的統計,還有近20種不同的PD-1單抗處在臨床階段。如果不能與此前獲批的產品產生療效上的顯著差異,這些臨床階段的產品將很難在市場上立足。
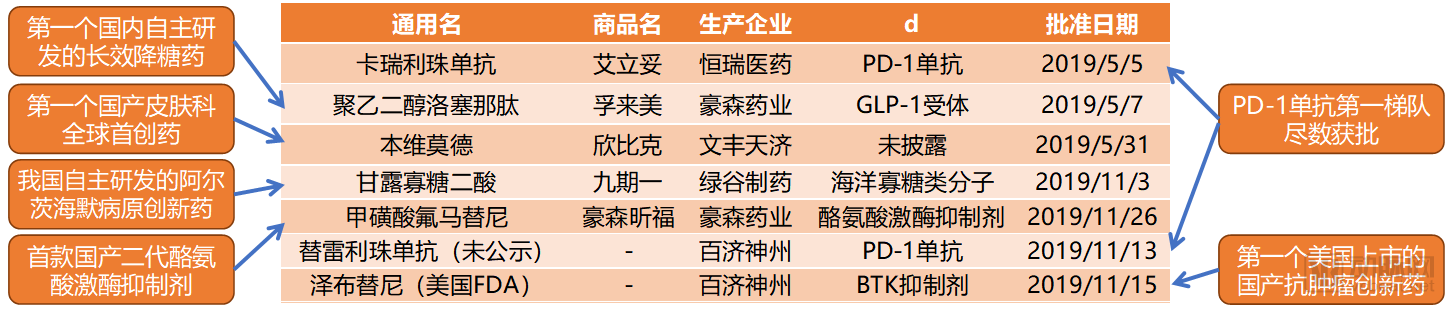
2019年獲批的國產創新藥
與2018年相比,2019年的國產創新藥沒能保持2018年的井噴水平。但每一款的含金量還是比較高。
繼2018年君實生物的拓益和信達生物的達伯舒上市之后,恒瑞醫藥和百濟神州的PD-1單抗也在2019年相繼獲批。至此,申報NDA的4個國產PD-1單抗品種全部上市,競爭正式進入適應癥拓展階段。
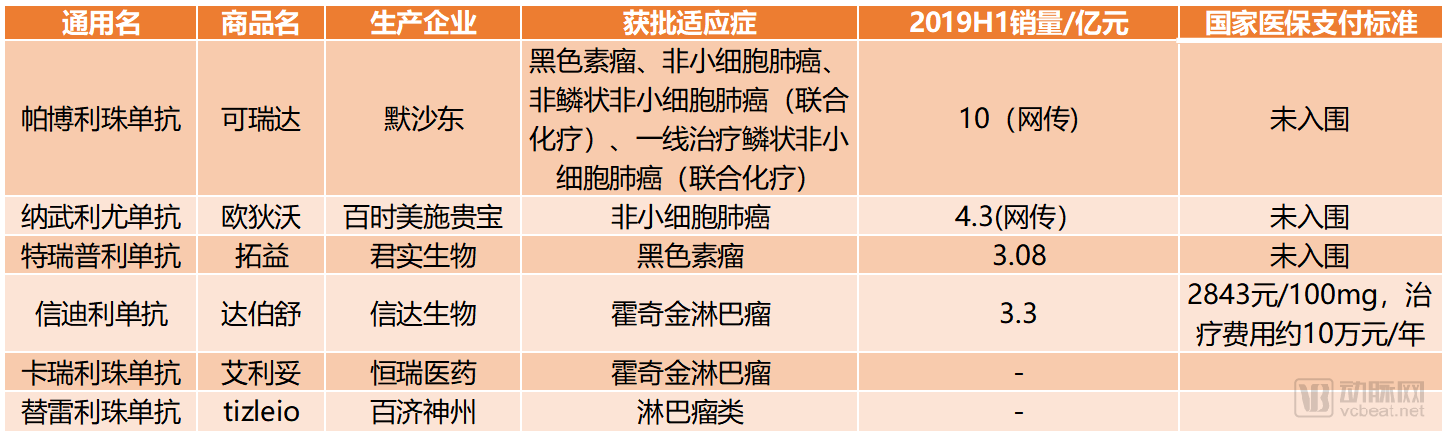
國內已獲批的6款PD-1單抗
在適應癥拓展上,可瑞達已經先行一步,在2019年連批三個肺癌相關的新適應癥。并且可瑞達2019年前三個季度全球銷量已經達到79.73億美元,基本鎖定年銷量突破100億美元,甚至可能超過來那度胺成為全球第二暢銷的藥物。
剛剛公布的醫保談判名單中,PD-1單抗的入圍情況發生了大反轉。原本外界一直以為至少兩個國產品牌會選擇主動降價進入醫保范疇,但是最終只有信達生物的信迪利單抗通過了談判。信迪利單抗的原售價為7838元/100mg,計算贈藥后每年的治療費用約16.7萬元。而進入醫保的信迪利單抗,年治療費用約為10萬元,相當于在贈藥方案的基礎上又降低了40%。
在第一梯隊盡數獲批之后,國內其他PD-1單抗研發企業的機會顯得愈發渺茫。產品逼近上市的企業還可以從適應癥或聯合用藥上找找機會,還在臨床前研發或早期臨床階段的企業將很難在市場上立足。希望這場“一窩蜂”式的研發歷程也能讓國內創新藥企業吸取教訓,尋找真正屬于自己的創新機會。
2019年批準的其他四款國產創新藥則各具特色。豪森藥業今年梅開二度,先是洛塞納肽與禮來的度拉糖肽在今年相繼獲批,與此前獲批的艾塞納肽微球同為長效GLP-1受體激動劑,呈三足鼎立之勢;年底氟馬替尼也獲批上市,而且Ⅲ期臨床試驗表現優于伊馬替尼(格列衛)。本維莫德作為我國首個獲批的皮膚科“First in Class”新藥,網上已經有大量患者曝光了自己的使用效果,大多數患者療效顯著。
與其他幾款藥物相比,年末獲批的九期一引來了大量爭議。根據九期一披露的實驗結果,其根據ADAS-cog12量表統計的數據,治療組和安慰劑組在36個月的治療后相對變化值相差2.54。且不論其實驗結果顯示的數據曲線是否有問題,單從ADAS-cog12量表上看,該量表總分為70或75分,在這一量表的測試中獲得2.54分的改善意味著這一藥品的療效微乎其微。也因此CDE批準該藥之后,這一產品引起了大量爭議。但是事已至此,我們只能期望九期一能在上市后表現出高于臨床試驗的優秀療效。
除國內獲批的藥品外,澤布替尼今年為國產創新藥的海外獲批實現了零的突破。在獲批過程中,澤布替尼還同時實現了多個第一,比如第一次以國內臨床試驗為主要獲批依據之一,國內臨床試驗機構首次接受美國FDA核查等等。澤布替尼一役,終于讓中國的創新藥正式進入全球序列。
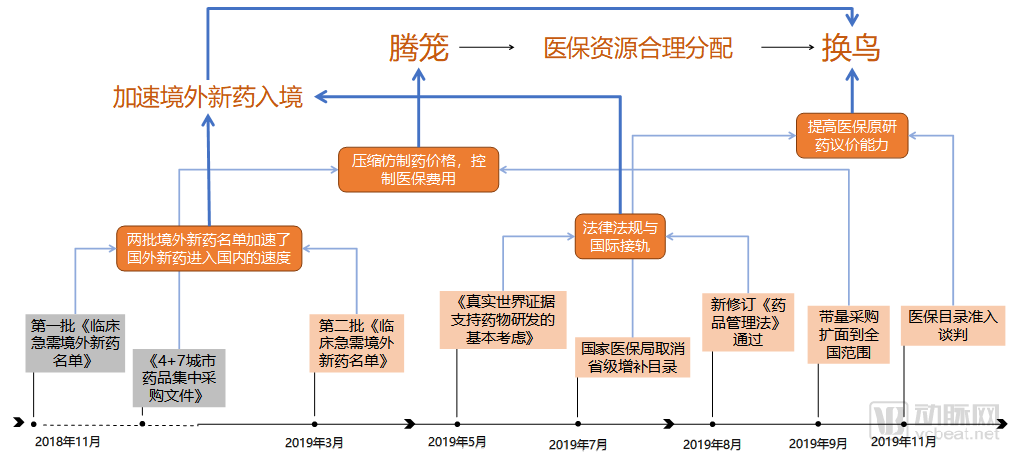 2019創新藥領域關鍵政策
2019創新藥領域關鍵政策
近幾天一件大事終于塵埃落定。原定11月11-13日的醫保談判延長到了15日,這次醫保準入談判納入了150個品類,規模空前。最終,有70款新藥成功入圍,27款藥品成功續約。我國醫保這場騰籠換鳥的大戲在帶量采購和大范圍醫保談判之后,來到了里程碑式的節點,并且已經卓有成效。
從2017年開始的醫保目錄準入談判如今已經進行了三年。本次談判的藥品除了2018年之前獲批但未進入醫保范疇的大量新藥、特藥,還包括2017年談判成功的藥品續約。本次談判中的部分藥品已經可以看到省級目錄取消之后,醫保局的議價能力提升。
最為明顯的是藥王修美樂(阿達木單抗)。阿達木單抗在2018年的售價為7600元/支左右。2019年該藥在全國各省市陸續降價60%進入地方醫保目錄,中標價基本統一為3160元/支。而本次醫保談判,阿達木單抗的價格直接降到了1290元/支,幾乎是全球最低。
然而在PD-1單抗的談判上,國家醫保局的談判并沒有大獲成功。四款藥品最終只有信達生物的信迪利單抗入圍,究其原因,可能跟信迪利單抗目前在CDE申報的新適應癥數量最少有關。
今年是取消地方醫保目錄之后的第一次談判,醫保和創新藥藥企都還不能很好的衡量自己在新環境下的議價能力,在談判中容易產生分歧,最終無法達成一致。本次未能通過談判的藥品在2020年底還將會迎來新一輪的醫保準入談判。屆時經過了一年的觀察,醫保和藥企應該會更明確自己在談判中的高低,最終讓更多藥品以雙方都能接受的價格進入醫保目錄。
在醫保開源方面,從2018年底藥品集中采購方案開始試點,到2019年9月擴面到全國,傳統仿制藥企業已經逐步意識到自己此前賴以生存的模式已經蕩然無存,取而代之的是進退兩難的局面。硬著頭皮進醫保,利潤微薄;不進醫保又沒有銷路。仿制藥企業站在命運的十字路口上四處張望,卻看不清未來的方向。
無論這些企業發展如何,醫保局在這項政策中完成了自己的一個小目標。仿制藥價格中的水分被充分擠出,讓醫保騰出了一部分籠子來放新的鳥。但是騰出了籠子的醫保局環顧四周發現并沒有很多合適的鳥可以塞到籠子里。鼓勵臨床急需的境外新藥進入國內就成了抓鳥進籠的最快途徑。本來很多企業仿制藥研發做的好好的,境外新藥名單一發,突然就閃了腰。
2019年的一系列動作之后,騰籠換鳥已經初顯成效。未來也會有更多從仿制藥中壓縮出的資金被分配到創新藥上,解決更多患者的用藥問題。
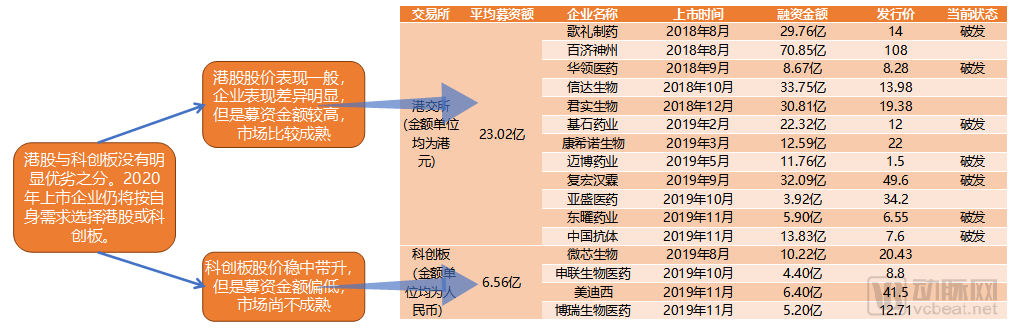
近兩年在科創板和港交所上市的創新藥企業(包括一家CRO和一家原料藥)
2018年4月,港交所開放未盈利生物科技企業上市,隨后掀起了一陣上市熱。本來應該在一級市場再摸爬滾打幾年的企業們紛紛調整姿態赴港上市。從2018年8月1日歌禮制藥率先上市開始,到2018年底,就有五家未盈利的生物醫藥企業在港交所掛牌,其吸引力可見一斑。于是2018年11月,中國證監會也宣布將在上海證券交易所設立科創板,中國二級市場的大門全面向創新藥敞開。
于是2019年,港股和科創板的接連開放,成功的把國內的企業留在了國內。十一家創新藥企業在中國的二級市場上輪番轟炸。
在科創板的排隊列表中,還有先導藥物、百奧泰生物制藥等多家企業,另外,和鉑醫藥、益方生物等近兩年獲得大額融資的企業還未宣布上市計劃,諾誠健華剛剛向港交所遞交招股書。2019年這股上市熱大概率會繼續蔓延到2020年。
在繁盛的同時,已經上市的創新藥企業也有喜有悲。港交所上市的12家企業中有7家破發,另外五家則分別是:國產PD-1雙子星君實生物、信達生物,自研新藥在美國上市的百濟神州,創新疫苗領頭羊康希諾生物和小分子新藥第一股亞盛醫藥。
可以明顯地看出,對于還在研發階段的創新藥企業,港股市場表現出了嚴苛的態度。被港股肯定的企業在牌面上就表現出極強的市場號召力,臉上還寫了個問號的創新藥企業,即使是香港本土的中國抗體,也沒能逃脫破發的命運。
相比于港股市場,內地股民們卻是一片普世歡騰的景象。科創板上的四支創新藥股票(包括CRO企業美迪西和原料藥企業博瑞生物制藥)都表現良好,微芯生物更是在開盤首日暴漲511%。內地股民們敲鑼打鼓的迎接創新藥企業,資本和企業想必都是很開心的。但科創板的熱度能夠持續多久,大幅暴漲背后是否是又一次市場的“不理智”,只有等待市場自己調節。
另一方面,科創板上市的企業募資金額普遍偏小。募資金額最大的微芯生物也只是將將超過10億元人民幣。相比于平均募資額超過20億港元的港股來說,上交所給企業的估值還是偏向保守,也因此我們才能看到微芯生物開盤大漲五倍的精彩瞬間。但是精彩歸精彩,對于產品已經進入沖刺階段,需要大筆資金支持的大型創新藥企業,科創板的募資水平確實有點不夠看。
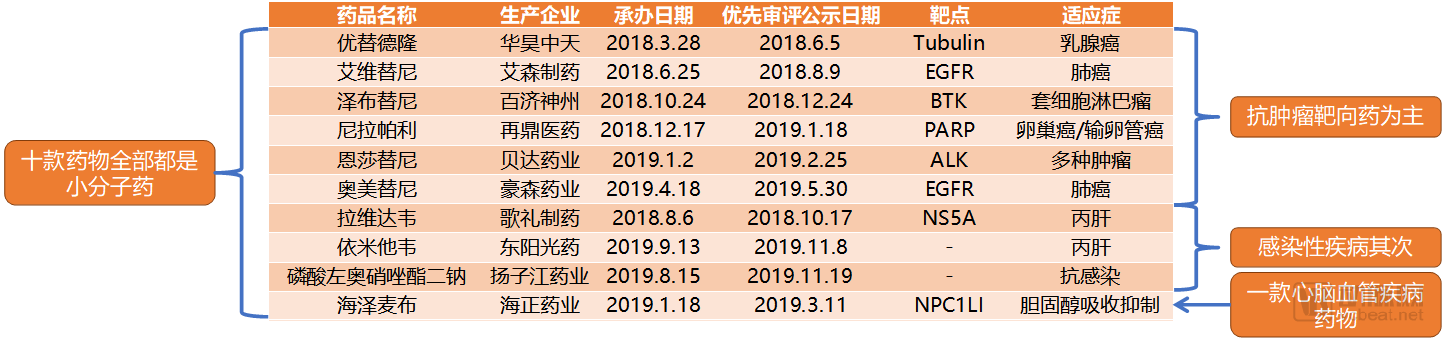
2020年或將在國內獲批的十大國產創新藥
2018-2019年十幾款國產創新藥上市之后,留在優先審評隊列里的國產創新藥正在變得越來越少。我們從優先審評名單中梳理出的或將在2020年上市的十款國產創新藥全部是小分子藥,國產大分子創新藥則在PD-1單抗悉數完成NDA之后暫時歸于平靜。
小分子靶向藥在靶點選擇上仍然以跟隨創新為主,比如三代EGFR靶向藥艾維替尼和奧美替尼;伊馬替尼的同類藥物氟馬替尼;ALK抑制劑恩莎替尼等。澤布替尼是其中含金量較高的一個,在FDA獲批之后,預計國內獲批也不會很遠。
近幾年,由于抗體藥物在全球范圍內的火爆,小分子靶向藥進入了短暫的低谷。但隨著時間的推移,大分子藥物原研難度高,周期長,成本高等問題開始浮現。反倒是小分子藥經過了幾年的沉淀之后,保持著穩定的產出效率。
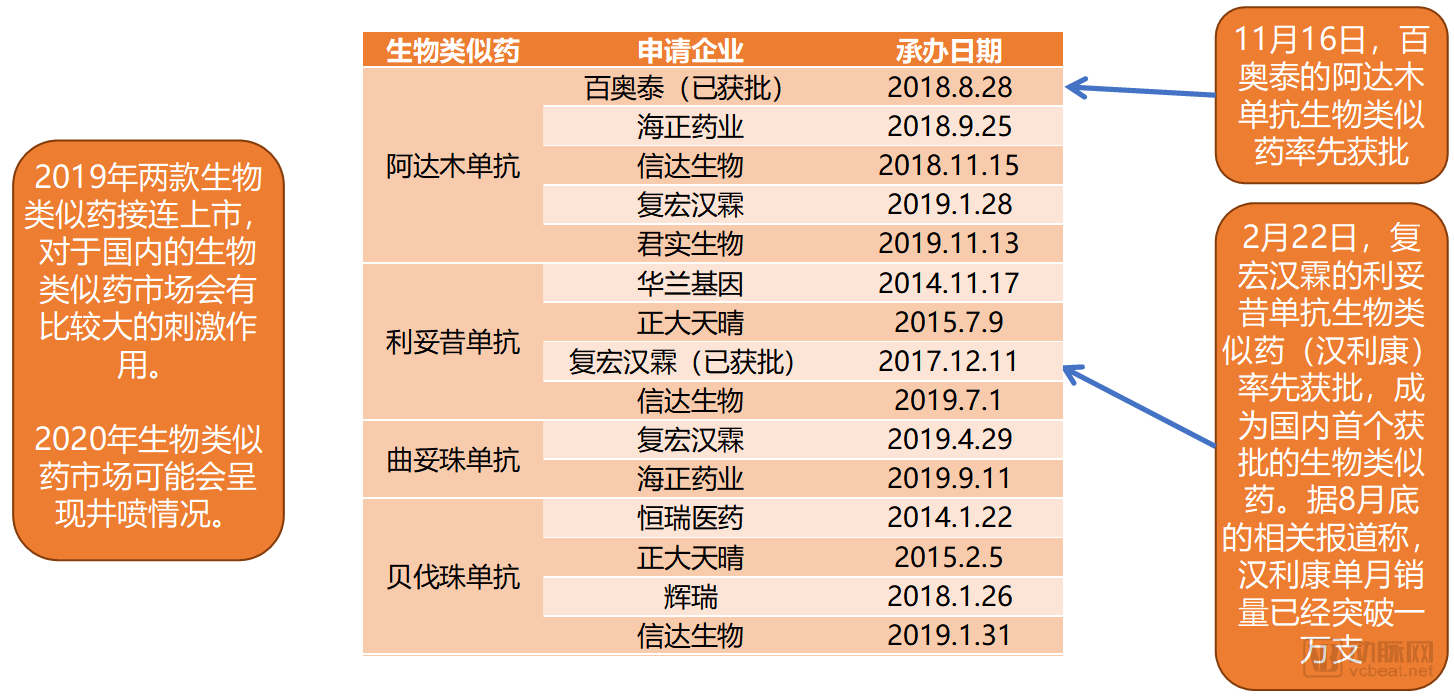
抗體藥物主要品種已申報上市的生物類似藥產品
但大分子藥也不會就這樣在2020年沉寂。2019年接連獲批的兩款生物類似藥開啟了抗體藥物重點品種國產化的時代。幾大重點品種都有多家企業的生物類似藥產品正在申報NDA。再加上醫保對藥品降價的需求,生物類似藥剛好可以契合。我們預計,2020年生物類似藥領域可能會迎來井噴。
與創新藥相比,生物類似藥的研發目標相對明確,研發流程短,市場規模穩定,上市效率也比較高,能較快回流資金。由于大分子的高門檻,生物類似藥也很難發生化藥仿制藥一樣的大量同類產品競爭。而且生物類似藥研發有利于讓團隊積累研發經驗,為創新藥研發做好準備。因此“先仿后創”,“以仿帶創”基本成為抗體藥物研發領域的普遍行業認知,也是目前國內環境下比較順暢的企業成長路線。
在2019年底的醫保準入談判中,阿達木單抗成功入圍,曲妥珠單抗和貝伐珠單抗也續約成功。這些原研藥品的生物類似藥在醫保準入中與仿制藥類似,與醫保進行簡單的支付標準溝通就可以被納入醫保范圍內,其適應癥也與原研藥完全一致。
國內抗體藥物的頭部企業幾乎都包含有部分生物類似藥管線。甚至國際藥企巨頭(如輝瑞)也在進行生物類似藥研發。從已經申報NDA的產品上看,復宏漢霖和信達生物都有多款產品處在隊列前列,很可能會在明年收獲滿滿。
1.投融資情況較2019年繼續提升,但很可能不會超過2018年同期水平;
2019年整體創新藥投融資已經回歸到正常的增長曲線上,分布情況也基本保持穩定。因此預計2020年創新藥領域將繼續沿此前的增長曲線增長,預計投融資總額在人民幣200-210億元。
2.國產創新藥回歸小分子,帶動小分子藥物領域熱度上升;
根據我們的統計,還在優先審評隊列中的國產創新藥產品,幾乎都是小分子藥物。我們列出的2020年或將上市的十大國產創新藥均是小分子。因此可以預見2020年的獲批主力將會是小分子創新藥,并進而拉動小分子藥物領域熱度上升。
3.大分子生物類似藥將迎來井噴,重點品種多數實現國產化;
隨著2019年大分子生物類似藥開閘,2020年會有更多生物類似藥獲批。在利妥昔單抗和阿達木單抗的首款產品獲批之后,其他重點品種的生物類似藥很可能會在2020年逐步被獲批。更多創新藥品種進入國產化序列。
4.醫保的騰籠換鳥繼續推進,更多創新藥進入醫保范疇;
帶量采購在2019年9月拓展至全國,2020年帶量采購政策的擴面必然會是醫保局工作的重心。另一方面,2019年底組織的大規模醫保準入談判囊括了截至2018年底獲批的大量藥品。未來這一談判可能會每年開展,加速創新藥進入醫保的效率。
5.上市企業按自身需求選擇科創板或港股,科創板發展逐步成熟。
在中美貿易摩擦未表現出明顯改善的情況下,國內市場會是準備上市企業的第一選擇。港股和科創板在上市方面各有自身的優勢,2020年預計企業仍會根據自己的需求進行選擇。而科創板作為2019年的熱門板塊,在最初的上市熱潮結束之后,也將會在2020年逐步進入平穩發展的狀態。
來源:動脈網 作者:郝翰
本文為本網轉載,出于傳遞更多信息之目的,并不意味著贊同其觀點或證實其內容的真實性,如涉及侵權,請權利人與本站聯系,本站經核實后予以修改或刪除。
請完善以下信息,我們的顧問會在1個工作日內與您聯系,為您安排產品定制服務
評論